永生化骨髓间充质干细胞模型的构建
【】2015-07-22 点击次数 次
程 斌:广州中医药大学祈福医院 广东广州 511495
程海燕:南昌大学第二附属医院 江西南昌 330000
永生化骨髓间充质干细胞模型的构建
程 斌 程海燕
CONSTRUCTION OF IMMORTALIZEDBONE MARROW MESENCHYMAL STEM CELLS
CHENG Bin, CHENG Haiyan
【摘 要】 目的 建立永生化大鼠骨髓间充质干细胞(BMSCs)模型的构建,为研究BMSCs的各种特性及临床应用奠定基础。方法 用LipofectamineTM 2000介导基因转染,将含有SV40T抗原基因的真核表达载体pCMVSV40T/PUR导入BMSCs,用嘌呤霉素筛选后并扩大培养,观察细胞形态及生长状况,绘制细胞生长曲线,用酶切法鉴定SV40T抗原基因在转染细胞中的表达,检测其是否成瘤。结果 第7代后的BMSCs,实验组细胞的生长速度明显高于对照组,且未发现成瘤性。结论 在体外培养条件下,pCMVSV40T/PUR可转染BMSCs使其永生化,为BMSCs在临床及科研的广泛应用提供基础。
【关键词】 SV40T,骨髓间充质干细胞,永生化,构建,模型
【Abstract】 Objective To establish immortalized bone marrow mesenchymal stem cells (BMSCs) from SD rats in vitro for further research on the characteristics and clinical application of BMSCs. Methods By using L ipofectamine TM 2000-mediated gene transfection, plasmid pCMVSV40T/PUR containing the simian virus 40 large T antigene gene (SV40Tag) was transfected into BMSCs. BMSCs were screened by puromycin and then cultured on an extended scale. Their cell morphology and growth conditions were observed. Growth curve of cells was graphed. The expression of SV40Tag in transfected cells was identified by enzyme digestion method for the detection of tumor formation. Results The growth rate of the experimental group of BMSCs after the 7th generation was significantly higher than that of the control group. No tumorigenicity was found in BMSCs after the 7th generation. Conclusion In vitro, the immortalized BMSCs by pCMVSV40T/PUR can provide basis on a large scale for its application in clinic and scientific research.
【Key words】 SV40T, Bone marrow mesenchymal stem cells (BMSCs), Immortalized, Construction, Model
【Author′s address】 Blessing Hospital of Guangzhou Traditional Chinese Medicine University, Guangzhou 511495, Guangdong Province, China
doi:10.3969/j.issn.1671-332X.2015.01.003
骨髓间充质干细胞(Bone marrow mesenchymal stem cells,BMSCs) 是目前干细胞移植治疗器官功能衰竭的热点。由于目前尚没有统一的表面标志物可以直接用于分离BMSCs,因此分离后的BMSCs 需要经过表面抗原的流式细胞仪检测及分化试验进行鉴定。然而分离鉴定成功的BMSCs 若不能及时应用,传代超过7 代后其活力、分化能力均明显下降,不能供进一步研究及应用[1] 。
因此,若能在体外建立永生化BMSCs的模型,从而为其临床及科研上的广泛应用提供前提。本实验通过pCMVSV40T/PUR质粒的导入建立永生化BMSCs的模型,并评价其效果。
1 材料与方法
1.1 实验材料
本实验中使用SD 清洁级大鼠购自南方医科大学动物实验室。DMEM 培养基购自Hyclone公司;胰蛋白酶购自AMERSCO 公司; Opti-MEM购自Invitrogen公司;胎牛血清购自美国Gibco公司。抗大鼠CD29、CD44、CD45为美国Pharmingen 公司产品; 限制性核酸内切酶NotⅠ和XhoⅠ、mc1061/P3细菌购自Invitrogen公司;脂质体Lipofectamine 2000 和Trizol试剂盒购自美国Gibco公司;pCMVSV40T/PUR质粒由瑞典JAN HOLGERSSON教授惠赠。
1.2 方法
1.2.1 BMSCs分离、培养、鉴定及传代 购制SD大鼠,取其前、后肢,采用percoll 梯度离心法分离纯化大鼠的BMSCs,流式细胞仪检测鉴定细胞类型,具体方法参照张刚庆[1]。原代细胞培养7~9天后,待细胞达70%~80%时,进行传代,具体方法参照张刚庆[1]。
1.2.2 质粒扩增 用冷的无菌枪头从mc1061/P3细菌悬液中取40 ul转移到15 ml无菌离心管中,每管加质料5 ul,混匀后,冰浴30 min,将管放在42°水浴中90s,迅速将管转移到冰浴中,使细胞冷却1~2 min,每管加200 ulL B培养基,用水浴将培养基加热到37°,然后将管转移到37°摇床内,45 min,将混合细胞均匀涂布于含50 ul/ml氨苄霉素的LB平板内,平板置于室温至液体被吸收,倒置平板于37°培养12~16 h,挑选阳性菌落,置于10 ml LB培养基中,37°摇菌12~16 h,根据试剂盒方法小剂量提取质料。
1.2.3 永生化BMSCs细胞株的建立 取第3代BMSCs,将其置于含10 %小牛血清、2 mmol/L L-谷氨酰胺,100 U/ml、100 μg/ml青霉素与100 μg/ml链霉素的DMEM培养基中培养,置于24孔培养板中,待细胞达80%~90%汇合时,移除上方原培养液,在每孔里加入500 ul Opti-MEM; 置备A、B液:取08 ug pCMVSV40T/PUR 质粒,将其加入到50 ul Opti-MEM中混合后置备A液;25 ul LipofectamineTM 2 000加入到50 ul Opti-MEM中,充分混合后,在室温下(20~25 ℃)培养5 min,置备为B液;A、B液混合后,在室温下培养20 min后,取该混合液加入到上述培养板中,每孔100 ul。充分混合后,在37 ℃ CO2培养箱中培养5 h后,将该培养基换为完全培养基。将上述BMSCs在室温下培养2 h后,加入嘌呤霉素至浓度为08 g/ml,5天后,进行分离及扩增。
1.2.4 分组 实验组为导入 pCMVSV40T/PUR 质粒的BMSCs,对照组为普通的BMSCs。
1.3 观察BMSCs增殖能力
1.3.1 细胞计数并描绘其生长曲线 未导入基因的BMSCs(对照组)传代至15代后其很难继续传代,故选取第15代BMSCs为研究对象,以12×104/cm2密度接种于12个6孔培养板内,实验组BMSCs为6个6孔培养板,对照组BMSCs为6个6孔培养板,每孔加2 ml,培养,分别于培养1~6天后,每天消化实验组BMSCs及对照组BMSCs各1个培养板,计数,取平均数,记录结果,描绘其生长曲线。
1.3.2 细胞计数 取10 ul细胞悬液加到计数板中计数。数细胞原则:对于压线的细胞,数上不数下,数左不数右。计算公式:4大格细胞总数×稀释倍数×104/4=细胞数/ml。
1.3.3 实验组细胞成瘤性 将实验组细胞传代至15代后,植入裸鼠皮下,4周后,观察其成瘤性。
1.4 统计学方法
采用SPSS 150统计软件包进行统计分析,计算资料以均数±s标准差表示,不同组间细胞存活率采用配对样本t检验分析, p< 005为差异有显著性。
2 结果
2.1 BMSCs的生物学性状 实验组BMSCs随着传代次数的增加其形态未见明显改变,当传代至10代时,细胞增长速度无减慢趋势,其形态于3~4代对照组细胞相似,胞核明显,胞质丰富,清晰,但仍具有生长抑制特性。对照组BMSCs在第7代时细胞增长速度减慢,约10天左右传一代,且细胞形态有所改变,当传至15代时,细胞表现出皱缩,体积增大,胞体变平。(见图1)
 A: 经质粒转染后15代的BMSCs; B: 未转染的15代的BMSCs
A: 经质粒转染后15代的BMSCs; B: 未转染的15代的BMSCs
图1 BMSCs的生物学性状(×200)
2.2 实验组BMSCs细胞株的鉴定
胡伟华等[2]采用NotⅠ和XhoⅠ酶切后,证实pCMV为3 kb, SV40T基因为23 kb,通过酶切后进行电泳分析(见图2),从该图可证明实验组BMSCs细胞株导入SV40T基因。

图2 酶切后的电泳分析
2.3 细胞计数结果
当实验组细胞传代至15代时,细胞存活率为(88±5)%,而对照组细胞存活率为(41±5)% (p<001),证明实验组细胞的存活率明显高于对照组。
2.4 两组细胞的生长曲线
以时间为横坐标,细胞数目为纵坐标绘制BMSCs生长曲线,实验组BMSCs的生长曲线呈“S”形,而对照组BMSCs较平坦,证明实验组BMSCs细胞的增长速度明显快于对照组BMSCs。
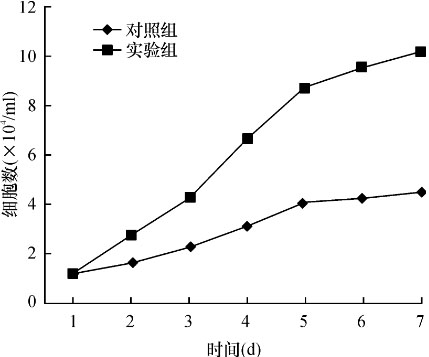
图3 实验组BMSCs 及对照组BMSCs的生长曲线
2.5 成瘤性 取15代实验组细胞植入裸鼠皮下,4周后,未见成瘤。
3 讨论
国内外研究表明,BMSCs具有极强的自我复制能力和多向分化潜能,来源广泛,易于获取,而且BMSCs具有低免疫原性,应用方便[3-5]。因此,BMSCs的诱导分化和移植是目前研究的热点之一。
KEIYA OZAWA等 [6-7]表明,骨髓间充质干细胞暴露于受损的肝脏组织中时可迅速转换成健康的肝脏细胞,并且可帮助修复受损的肝脏;BMSCs的移植可以在体内修复受损的肝脏,而对非受损肝脏无明显影响。王连友等[8]通过对大鼠进行同种异体BMSCs移植,发现移植的BMSCs优先定居于受损的大鼠肝脏,分化为成熟的肝细胞并增殖,移植后1周内受损大鼠肝脏功能恢复。有研究表明利用密度梯度离心的方法,从大鼠骨髓中分离纯化出BMSCs,通过将其与肝细胞联合培养、培养剂中添加肝细胞生长因子(HGF)的方法,利用了肝细胞生长发育的微环境条件、细胞因子来诱导其分化,结果表明BMSCs经诱导后,从形态学和肝细胞标志物的检测发现其均可被诱导分化为肝细胞[9]。因此我们认为BMSCs在一定条件下,在体内、外均可诱导分化为肝细胞,修复受损肝脏。虽然如此,但BMSCs移植尚存在细胞数量不足,需要体外扩增,体外传代、保存及复苏后增殖及分化能力下降等问题,严重影响其进一步广泛应用。
近年来,有研究者提出了永生化(immortalization)的概念,旨在使细胞从增殖衰老危机中逃逸,从而具有无限增殖能力[10]。永生化(reversible immortalization)技术因可保持细胞良好的增殖能力而受到广泛关注。目前促使细胞永生化的常用方法主要有病毒转染、端粒酶活化、癌基因、原癌基因转染等。较常用的一种方法是先将永生化基因SV40T导入细胞以获得永生化细胞株,使其获得体外大量增生能力 [11]。当前软骨细胞传代至第5代时,其开始向其它细胞分化,故存在体外增殖困难, Shuwei Zhang等 [12] 发现SV40T具有避免细胞凋亡及延长细胞寿命的特性,通过将pCMVSV40T/PUR质粒导入前软骨细胞后,发现细胞的生长呈S形,随着培养时间的延长,细胞数量随之增加,端粒酶长度也未见明显减短,且在无细胞生长因子的情况下当传代至30代时仍无向其它细胞分化的趋势。但永生化BMSCs尚无进一步报道。
本研究通过pCMVSV40T/PUR质粒导入SD大鼠BMSCs中,建立永生化模型。发现对BMSCs的体外扩增有重要的作用,通过对其生长曲线等研究发现其在15代后仍保持快速的增长,而对照组7代后细胞增长速度减慢,15代后活性很差,很难继续扩增,这对于细胞的扩增有重要意义,同时可应用于人工肝,为肝细胞来源短缺提供一新的出路。通过对第15代永生化BMSCs仍保持快速的增长,且不具有成瘤性,使得永生化BMSCs具有广泛的临床应用价值。
参考文献
[1] 张刚庆,方驰华,池达智. 大鼠骨髓间质干细胞原代培养换液频度与细胞增生的关系. 世界华人消化杂志, 2004, 12: 1953-1955.
[2] 胡伟华,郭风劲,张树威,等SV40T抗原基因永生化新生大鼠前软骨干细胞株的构建.Herald ofMedicine,2007,26(5),460-464
[3] 曲乃方,张 璞,陈耀凯,等.骨髓干细胞移植治疗急性肝衰竭的实验研究.Infect Dis Info, 2006, 19(5):266-268.
[4] 鲁学恒,马 力,刘 沛.体外诱导大鼠骨髓间充质干细胞向肝细胞分化的实验研究.中国医科大学学报,2007,36(3):256-258.
[5] 陈凯佳,肖 莹,刘小斌,等.强肌健力口服液含药血清对大鼠骨髓间充质干细胞成肌分化的影响.现代医院,2009,8(9):9-10.
[6] KEIYA OZAWA, KAZUYA SATO, IEKUNI OH, et al. Cell and gene therapy using mesenchymal stem cells (MSCs). Journal of Autoimmunity,2008,1:1-7.
[7] KIYOHITO YAGI,MIDORI KOJIMA,SUGURU OYAGI, et al.Application of MesenchymalStem Cells to Liver Regenrative Medicine.The Pharmaceutical Society of Japan,2008,128(1):3-9.
[8] 王连友,徐 辉,董世武,等. 异体骨髓间充质干细胞在骨髓嵌合小鼠体内分化为肝细胞的实验研究. 第三军医大学学报, 2007,29(11):993-995.
[9] ZHANG YI, CHE YUAN -MEI, WANG YANG. Hepatocyte grow th factor and basic fibro blast growth factor induce differentiation of human bone marrow mesenchymal stem cells into hepatic lineage cells.Journal of Clinical Rehabilitative Tissue Engineering Research,2007,11(7):1397-1400.
[10] SHAY JW, WRIGHT WE. Senescence and immortalization: role of telomeres and telomerase. Carcinogenesis, 2005,26:867.
[11] QIU HY, FUJIMORI Y, NISHIOKA K,et al. Postnatal neovascularization by endothelial progenitor cells immortalized with the simian virus 40T antigen gene. Int J Oncol,2006,28(4):815-821.
[12] SHUWEI ZHANG,ANMIN CHEN,WEIHUA HU,et al. Immunological puriWcation of rat precartilaginous stem cells and construction of the immortalized cell strain. Archives of Orthopaedic and Trauma Surgery,2008,4(1):40-43.
版权与免责声明:
① 本网版权均属于现代医院杂志社,转载、摘编应在授权范围内使用,应注明"来源出处:《现代医院》杂志社"。违者本网将追究相关法律责任。
② 如有疑问和问题请联系现代医院杂志社服务热线:020-83310901 83310902


